XX amžiaus pradžia buvo labai palankus metas mokslams. Be Ernesto Rutherfordo ir Nielso Bohro, pagimdžiusio standartinį dalelių fizikos modelį, tai taip pat buvo proveržis kvantinės mechanikos srityje. Vykdydami elektronų elgsenos tyrimus, mokslininkai pradėjo siūlyti teorijas, pagal kurias šios elementariosios dalelės elgėsi taip, kad nepaisė klasikinės, Niutono fizikos.
Vienas tokių pavyzdžių yra Erwino Schrodingerio pasiūlytas elektronų debesies modelis. Šio modelio dėka elektronai nebebuvo vaizduojami kaip dalelės, judančios aplink centrinį branduolį fiksuotoje orbitoje. Vietoj to, Schrodingeris pasiūlė modelį, pagal kurį mokslininkai galėjo tik pagrįstai spėlioti elektronų padėtis. Taigi jų vietas būtų galima apibūdinti tik kaip „debesies“ aplink branduolį, kuriame greičiausiai randami elektronai, dalį.
Atominė fizika iki XX a.
Ankstyviausi žinomi atominės teorijos pavyzdžiai yra kilę iš senovės Graikijos ir Indijos, kur tokie filosofai kaip Demokratas postuliavo, kad visa materija yra sudaryta iš mažų, nedalomų ir nesunaikinamų vienetų. Terminas „atomas“ buvo sugalvotas senovės Graikijoje ir paskatino minties mokyklą, vadinamą „atomizmu“. Tačiau ši teorija buvo labiau filosofinė, o ne mokslinė.
Atomų teorija buvo suformuluota kaip mokslinis dalykas tik XIX amžiuje, kai buvo atlikti pirmieji įrodymais pagrįsti eksperimentai. Pavyzdžiui, aštuntojo dešimtmečio pradžioje anglų mokslininkas Johnas Daltonas panaudojo atomo sąvoką, kad paaiškintų, kodėl cheminiai elementai reagavo tam tikrais pastebimais ir nuspėjamais būdais. Atlikdamas eksperimentus su dujomis, Daltonas sukūrė vadinamąją Daltono atominės teorijos teoriją.
Ši teorija išplėtė masės ir apibrėžtų proporcijų pokalbio dėsnius ir atėjo į penkias prielaidas: gryniausioje būsenoje esantys elementai susideda iš dalelių, vadinamų atomais; konkretaus elemento atomai yra vienodi iki pat paskutinio atomo; skirtingų elementų atomus galima atskirti pagal jų atominius svorius; elementų atomai susijungia ir sudaro cheminius junginius; atomai negali būti nei sukurti, nei sunaikinti cheminės reakcijos metu, tik keičiasi grupė.
Elektrono atradimas:
XIX amžiaus pabaigoje mokslininkai taip pat pradėjo teoretikuoti, kad atomas sudarytas iš daugiau nei vieno pagrindinio vieneto. Tačiau dauguma mokslininkų išdrįso, kad šis vienetas bus mažiausio žinomo atomo - vandenilio - dydžio. XIX amžiaus pabaigoje jo padėtis drastiškai pasikeis dėka tokių mokslininkų, kaip seras Josephas Johnas Thomsonas, atliktų tyrimų.
Atlikdamas daugybę eksperimentų, naudojant katodinių spindulių vamzdelius (žinomus kaip „Crookes“ vamzdis), Thomsonas pastebėjo, kad katodinius spindulius galima nukreipti elektriniu ir magnetiniu laukais. Jis padarė išvadą, kad užuot sudarytos iš šviesos, jos buvo sudarytos iš neigiamai įkrautų dalelių, kurios buvo 1 tūkstantį kartų mažesnės ir 1800 kartų lengvesnės už vandenilį.

Tai iš tikrųjų paneigė nuostatą, kad vandenilio atomas yra mažiausias materijos vienetas, ir Thompsonas nuėjo toliau, norėdamas pasakyti, kad atomai yra dalijami. Norėdami paaiškinti bendrą atomo krūvį, kurį sudarė tiek teigiami, tiek neigiami krūviai, Thompsonas pasiūlė modelį, pagal kurį neigiamai įkrauti „kūneliai“ buvo paskirstyti vienodame teigiamo krūvio jūroje - žinomu kaip slyvų pudingo modelis.
Šie korpusai vėliau bus pavadinti „elektronais“, remiantis teorine dalele, kurią 1874 m. Numatė anglo-airių fizikas George'as Johnstone'as Stoney. Ir iš to gimė slyvų pudingo modelis, taip pavadintas todėl, kad jis labai panašus į Anglijos dykumą, kurią sudaro slyvų pyragas ir razinos. Ši sąvoka pasauliui buvo pristatyta 1904 m. Kovo mėn. JK leidime Filosofinis žurnalas, plačiai pripažinti.
Standartinio modelio kūrimas:
Vėlesni eksperimentai atskleidė nemažai mokslinių problemų, susijusių su slyvų pudingo modeliu. Pradedantiesiems kilo problema įrodyti, kad atomas turėjo vienodą teigiamą foninį krūvį, kuris buvo žinomas kaip „Thomsono problema“. Po penkerių metų modelį paneigia Hansas Geigeris ir Ernestas Marsdenas, kurie atliko eksperimentų seriją, naudodami alfa daleles ir aukso foliją - dar žinomą. „auksinės folijos eksperimentas“.
Šiame eksperimente Geigeris ir Marsdenas išmatuojo alfa dalelių išsklaidymo modelį fluorescenciniu ekranu. Jei Thomsono modelis būtų teisingas, alfa dalelės netrukdomai praeitų per folijos atominę struktūrą. Tačiau jie vietoj to pažymėjo, kad nors dauguma šaudė tiesiai pro šalį, kai kurie iš jų buvo išsibarstę įvairiomis kryptimis, o kai kurie grįžo šaltinio kryptimi.

Geigeris ir Marsdenas padarė išvadą, kad dalelės buvo susidūrusios su daug didesne elektrostatiniu jėga, nei leidžia Thomsono modelis. Kadangi alfa dalelės yra tik helio branduoliai (kurie yra teigiamai įkrauti), tai reiškė, kad teigiamas krūvis atome nebuvo plačiai išsisklaidęs, o susikaupęs mažame tūryje. Be to, tai, kad tos dalelės, kurios nebuvo deformuotos, praėjo pro kliūtis, reiškė, kad šias teigiamas erdves atskyrė didžiulės tuščios erdvės įdubos.
Iki 1911 m. Fizikas Ernestas Rutherfordas išaiškino Geigerio-Marsdeno eksperimentus ir atmetė Thomsono atomo modelį. Vietoj to, jis pasiūlė modelį, kuriame atomą sudarė daugiausia tuščia erdvė, o visas jo teigiamas krūvis buvo sukoncentruotas jo centre labai mažame tūryje, kurį supa elektronų debesis. Tai buvo žinoma kaip Rutherfordo atomo modelis.
Vėlesni Antoniaus Van den Broeko ir Nielso Bohro eksperimentai patobulino modelį. Nors Van den Broekas teigė, kad elemento atominis skaičius yra labai panašus į jo branduolinį krūvį, pastarasis pasiūlė į saulės sistemą panašų atomo modelį, kur branduolyje yra teigiamo krūvio atominis skaičius ir jį supa lygus elektronų skaičius orbitos apvalkaluose (dar žinomas kaip Bohro modelis).
Elektronų debesies modelis:
1920-aisiais austrų fizikas Erwinas Schrodingeris susižavėjo Makso Plancko, Alberto Einšteino, Nielso Bohro, Arnoldo Sommerfeldo ir kitų fizikų teorijomis. Per tą laiką jis taip pat įsitraukė į atominės teorijos ir spektro sritis, tyrinėdamas Ciuricho universitete ir vėliau Berlyno Friedricho Wilhelmo universitete (kur 1927 m. Jis pakeitė Planką).

1926 m. Schrödingeris nagrinėjo bangų funkcijų ir elektronų problemą daugelyje straipsnių. Be to, kad aprašė tai, kas vadinama Schrodingerio lygtimi - dalinine diferencialine lygtimi, apibūdinančia, kaip kintamoji kvantinės sistemos būsena keičiasi laikui bėgant - jis taip pat naudojo matematines lygtis, kad apibūdintų tikimybę rasti elektroną tam tikroje padėtyje. .
Tai tapo pagrindu vadinamajam elektronų debesies (arba kvantiniam mechaniniam) modeliui, taip pat Schrodingerio lygčiai. Remiantis kvantų teorija, teigiančia, kad visa materija turi savybių, susijusių su bangos funkcija, elektronų debesies modelis skiriasi nuo Bohro modelio tuo, kad neapibrėžia tikslaus elektrono kelio.
Remdamasis tikimybių funkcija, jis numato tikėtiną elektrono buvimo vietą. Tikimybės funkcija iš esmės apibūdina į debesis panašią sritį, kurioje greičiausiai bus rastas elektronas, taigi ir pavadinimą. Kur debesis yra tankiausias, didžiausia elektronų radimo tikimybė; o ten, kur elektronų yra mažiau, debesis yra mažiau tankus.
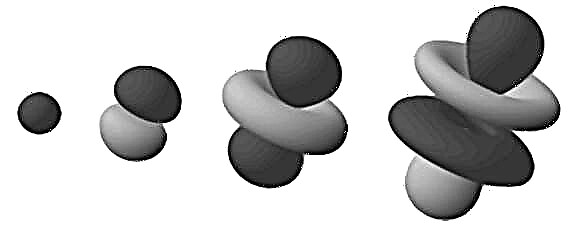
Šios tankios sritys yra žinomos kaip „elektronų orbitalės“, nes jos yra labiausiai tikėtina vieta, kurioje bus rastas orbitą keliantis elektronas. Išplečiant šį „debesies“ modelį į trimatę erdvę, matome štangos arba gėlės formos atomą (kaip paveikslėlyje viršuje). Čia išsišakoję regionai yra tie, kuriuose greičiausiai randame elektronus.
Dėka Schrodingerio darbo, mokslininkai pradėjo suprasti, kad kvantinės mechanikos srityje neįmanoma žinoti tikslios elektronų padėties ir impulsų tuo pačiu metu. Nepaisant to, ką stebėtojas iš pradžių žino apie dalelę, jie gali numatyti tikėtiną jos sekančią vietą ar impulsą.
Bet kuriuo metu jie negalės išsiaiškinti nė vieno. Tiesą sakant, kuo daugiau jie žinos apie dalelės impulsą, tuo mažiau jie žinos apie dalelės vietą ir atvirkščiai. Tai yra tai, kas šiandien žinoma kaip „netikrumo principas“.
Atkreipkite dėmesį, kad ankstesnėje pastraipoje minimi orbitalai yra sudaryti iš vandenilio atomo (t. Y. Turint tik vieną elektroną). Kai dirbama su atomais, turinčiais daugiau elektronų, elektronų orbitos sritys tolygiai pasiskirsto sferiniame pūliniame rutulyje. Čia tinkamiausias yra terminas „elektronų debesis“.
Šis įnašas buvo visuotinai pripažintas kaip vienas iš 20-ojo amžiaus svarių įnašų ir tas, kuris sukėlė revoliuciją fizikos, kvantinės mechanikos ir iš tikrųjų visų mokslų srityse. Vėliau mokslininkai dirbo ne toje visatoje, kuriai būdingi laiko ir erdvės absoliutai, o kvantiniai neapibrėžtumai ir laiko-erdvės reliatyvumas!
Čia „Space Magazine“ esame parašę daug įdomių straipsnių apie atomus ir atominius modelius. Štai kas yra Johno Daltono atominis modelis ?, Kas yra slyvų pudingo modelis ?, Kas yra Bohro atominis modelis ?, Kas buvo Demokratas? Ir kas yra atomo dalys?
Norėdami gauti daugiau informacijos, būtinai patikrinkite, kas yra kvantinė mechanika? iš gyvojo mokslo.
Astronomijos aktoriai taip pat turi epizodą šia tema, pvz., Episode 130: Radio Astronomy, 138 Episode: Quantum Mechanics ir 252 Episode: Heisenberg Unceurity Principle.